货号:PK0026
存储条件:-20℃避光保存,有效期1 年;如有结晶需在37℃水浴溶晶。因在乙醇中贮藏,所以要盖紧防挥发。
组分:
组分/规格 | 0.1ml | 1ml | 5ml |
PKH26染料 | 0.1ml (2mM) | 1ml (2mM) | 5ml |
稀释液C | 50ml | 500ml | 1200ml |
产品描述
PKH26荧光细胞连接试剂盒能够将带有长脂质尾巴的橙色荧光染料结合到细胞膜脂质区域上。染色方式依赖于细胞与膜的类型,主要用于细胞体外标记、体外细胞增殖研究及体内外细胞示踪研究。试剂盒中提供染色过程中所需的溶剂(稀释液C),该溶剂可以可以在染色过程中,增加染料溶解度和染色效率,同时维持细胞活力。稀释液C与哺乳动物细胞等渗,且不含去垢剂或有机溶剂,也不含生理盐水和缓冲盐。根据细胞类型及标记后细胞膜内在的变化,标记后的细胞表面会由均一透亮变得有点状凸起或补丁状。但在生理范围内,PKH26荧光不受pH的影响,每个细胞的荧光强度与染料标记位置无关。
PKH26 荧光在橙色区域(λex=551nm,λem=567 nm),可用来标记追踪体内外多种细胞。在细胞毒性分析,荧光蛋白、抗体或DNA染料在该区域发出的紫色、绿色、红色和远红外等,不会与PKH26产生干扰。PKH26最常被用于基于染料稀释增殖的分析的染料稀释应用,包括建立抗原特异性前体频谱和正常或肿瘤组织中静止或缓慢干细胞或祖细胞的鉴定。同时PKH26也可用于监测外来病毒、血小板和其他纳米颗粒的摄入;干细胞分裂过程中膜的分配;细胞-细胞之间膜的转移;细胞吞噬作用;抗原呈递;粘附;通过间隙连接的信号传递;以及组织切片中的神经元迁移。PKH26 荧光稳定性很强,特别是标记的细胞的研究周期超过1周时PKH26被用于体内细胞追踪研究。
操作注意:快速均匀的混合对标记也很重要,为获得最佳效果应采取下述措施:
1.混合时细胞悬液和工作染液应等量;
2.避免染太多(>5ml)或太少 (<100ul)的液体。避免用沾血清的移液管加染料;
3.液体量应尽可能精确以保证细胞和染料浓度被精确复制。
4.染料和稀释液作用于细胞的时间尽量短,有一定毒性。可用稀释液按上述步骤作用于细胞看其受损程度。
5.加等量血清终止反应,在终止染色反应前别离心稀释液C中的细胞,清洗时用含血清培养基可增加清洗效果。
6.细胞应单独移至新试管中离心,清洗3次时不用稀释液 C而是用培养基。
7.可用于体外干细胞、淋巴细胞、单核细胞、内皮细胞等的标记较理想。
8.全细胞标记应先于单抗染色的标记,当 4℃单抗染色时细胞跟踪探针将保持稳定;如后于单抗染色的标记,很可能出现“盖帽”现象。
9.染色细胞用2%多聚甲醛固定稳定性达3w 以上。
所需材料:
均匀的单细胞悬液;含血清培养基;清培养基或不含Ca2+Mg2+的PBS液;血清、白蛋白或与培养基兼容的蛋白源;聚丙烯锥形离心管;温度可控的离心机(0-1000g);荧光分析仪(荧光计,荧光显微镜,流式细胞仪,荧光图象分析仪);超净台;细胞计数仪;载玻片。
操作步骤:
一、一般细胞膜标记
亲脂性染料结合到细胞膜上完成标记。染色强度是染料浓度和细胞浓度的函数,与渗透性无关。因此,保证染料添加量不过量非常关键。过标记的细胞将会导致细胞膜完整性缺失和或降低细胞活性。
下列过程可用于体内体外细胞的标记,包括干细胞、淋巴细胞、单核细胞、内皮细胞、神经细胞或者任何其他细胞。体内细胞的标记过程需一定的改进,如血小板的染色,或者选择性标记吞噬细胞。
下述染色过程中细胞浓度和染料浓度代表操作的起始浓度。该浓度被证明适用于多种细胞。使用者需通过评估染色后细胞活率(如,PI 染色)、荧光强度、染色均匀度及是否对所研究细胞功能有影响等,根据实验的要求,确定最优的染料浓度和细胞浓度。
无菌操作示范步骤(总体积 2ml,染色终浓度为 2x10-6M PKH26染料和 1x107细胞/ml,所有操作在 20~25℃)
1. 胰酶和/或 EDTA 消化细胞形成单细胞悬液,将 2x107个细胞于锥形离心管中,用无血清培养基洗1次。
注意:血清蛋白和脂质会与染料结合,降低与细胞膜结合的染料浓度。最好在用稀释液C重悬细胞染色前(第四步)用无血清培养基或缓冲液洗细胞1次。
2. 400xg 离心 5 分钟形成松散的细胞团。
注意:PKH26染料不能直接加到离心沉淀中,这样会造成细胞染色不均一和细胞活力降低。
3. 离心后,轻轻小心的吸弃上层清液,细胞团上剩余液体<25ul。
注意:为得到可重复的实验结果,在用稀释液C重悬时,减少残留培养基或缓冲液体积非常重要。
4. 加入 1mL 稀释液C,用移液管轻轻吹打混匀,制备 2x细胞悬液。重悬细胞保证完全离散,别震荡,不要让细胞在稀释液 C 中保存太长时间。
注意:生理盐的存在会使得染料结团并大幅降低染色效率。需确保染色时细胞悬浮于稀释液C中,不含培养基或缓冲盐,
5. 临染色之前,将 4uL PKH26 乙醇溶液加入 1mL 稀释液 C 中,充分混匀,配制的 2x染色液(4×10-6M)
注意 1:为减少乙醇对细胞活率的影响,步骤5加的染料使得步骤6中EtOH最终浓度不能超过 1-2%。
注意 2:如果所需染料最终浓度<2x10-6M,需100%EtOH将 PKH26 稀释于另一个单独的容器中,以确保实验结果的可重复性。
6. 快速将 1mL 2x细胞悬液(步骤 4)加入1mL 2x染色液(步骤 5)中,立即用吸管均匀快速混合样品,因为均匀的染色是在瞬间发生的。(最终细胞浓度为 1x107/mL,PKH26 浓度为 2x10-6M)。
注意:由于染色瞬间完成,快速将细胞与染料混匀对得到明亮、均匀和可重复的标记结果非常重要。为获得最佳效果应采取下述措施:
a.不要将 PKH26 染料直接加入含 2x细胞的稀释液 C 中。
b.将 2x细胞悬液(步骤 4)与 2x染色液(步骤 5)等体积混合。
c.调整 2x细胞和 2x染料的浓度避免染色体积太小(<100uL)或太大(>5mL)。
d.用电动移液器快速将细胞和染料混匀。血清移液管混匀速度太慢而使得染色不均匀。震荡和旋涡震荡混匀同样混匀较慢,染色均一性较差。
e.分配体积尽量准确,以保证样品与样品之间,实验与实验之间的可重复性。
7. 混匀后的染色的细胞 25℃孵育的 2-5min,定时轻轻颠倒离心管保证在 25℃充分混匀。由于染色速度较快,延长孵育时间对实验没有帮助。
注意:让细胞在染色液中停留尽量短的时间,同时保证得到理想的染色强度。因为稀释液 C缺少生理性盐,过长时间的暴露在稀释液C中会造成某些细胞活力降低。如果不能确定其影响程度,可增加仅作稀释的对照组和只用EtOH而不加染料染色的对照组。
8. 加入等体积的血清(2mL)或加入等量血清或1%BSA 终止染色反应,孵育 1min 以结合多余的染料。
注意1:血清(或等效的蛋白浓度)为最优的终止液。如果用完全培养基(含血清的组织培养基)替代,添加体积为10mL。
注意 2:不要通过加稀释波C 或离心来终止反应。
注意3:不要用无血清培养基或缓中盐,他们会使染料产生聚集。染料聚集使清洗过程中无法洗净,使得分析过程中仍存在未标记的细胞。
9. 将细胞在20-25℃条件下 400xg 离心 10 min,小心吸弃上清。用10mL 完全培养基(含血清的组织培养基)重悬,将重悬液转移至另一个新的无菌离心管中,20-25℃条件下400xg离心5min。用 10mL 完全培养基再清洗两遍以除去没结合的染料。
注意 1:将重悬液转移至新离心管中,减少了离心管壁残留的染料对洗涤效率的影响;
注意2:不要用稀释液 C 清洗。
10. 最后一步清洗后,用10mL完全培养基重悬细胞评估细胞回收率/细胞活率和荧光强度。离心重悬细胞至所需活细胞浓度。
注意 1:染色后的细胞可以用中性甲醛固定,避光条件下,荧光强度至少3周内保持稳定。
注意 2:染色荧光强度一般为背景的 100-1000 倍。虽然染色的 CV 值与细胞种类有关,但荧光分布应该尽量均匀对称。
11. 荧光显微镜/流式细胞仪分析细胞。检查细胞复苏情况、传代情况及荧光浓度。染色应均匀,比本底荧光高100-1000倍。
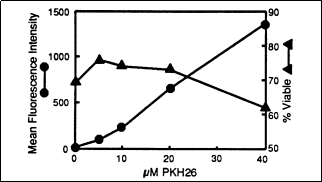
MC-38 TIL 细胞用上述指定 PKH26 浓度染色,最终细胞浓度为 1x107/ml)。活力(▲)由 FITC 染色测定,平均荧光强度(●)流式细胞仪检测。用20μM PKH26 标记后,抗肿瘤 TL 特异性和效能没有改变。
二、组织染色:
制备和保存含PKH标记细胞切片时要冰冻切片和特殊的封固标本技术。
切片制备:
1. 切除组织后立即放入干冰冰冻。
2. 切片前-70℃保存。
3. 用OCT(Tissue-Tek; Miles, INC.)复合物制作冰冻切片。
4. 4-5um组织切片。
5. 载玻片室温下干燥1h。
6. 封固盖玻片用1-2滴氰基丙烯酸盐粘合剂酯胶。
7. 检查和拍片时,用标准的滤光器如FITC(PKH2和PKH67)或TRITC(PKH26)。
复染切片:
1. 将玻片浸在丙酮液24-48h,去除盖片;
2. 蒸馏水清洗去丙酮;
3. 复染切片易用Mayer或Harris苏木精;
4. 封固载玻片用AS/AP永久性水合封固液(Bio/Can America, Inc.,Porland, ME)
注意:由于有机溶剂可析取PKH染液,而复染又吸收荧光,因而同时观察组织学和PKH荧光不可取。
三、外泌体染色
外泌体作为细胞外囊泡(Extracellular vesicle;EV)的一种,与癌症的恶化与转移密切相关,外泌体相关的 研究也逐渐成为了关注的热点。为了研究通过外泌体的细胞间通信,细胞摄入外泌体时的示踪技术非常重要。PKH26和PKH67作为新型荧光染料,可满足多重染色在内的各种实验需求。
外泌体蛋白定量:取适量外泌体进行BCA蛋白浓度测定以确定外泌体蛋白量。
配制PKH工作液:用稀释液C将PKH稀释10倍,配制成工作液(现配现用)
准备细胞:将细胞接种到培养皿中,并在 37℃ 5% CO2培养箱中预培养一段时间。
Exosome 染色
表 1. 染色时所需的 Exosome 的量
外泌体蛋白量 | 10~200 ug |
PKH工作液用量 | 50 uL |
'*上述外泌体的量是使用超速离心法获得的外泌体的大概的量。
*染色所需的外泌体的量因外泌体纯化条件和细胞种类而异。第一次染色时,请预先摸索外泌体的最佳用量。
*通过聚合物沉淀获得的外泌体会受到剩余聚合物的影响,因此无法用本试剂盒染色。
1. 吸取 100 uL悬浮于 PBS 中的外泌体至微型管中。
2. 吸取 2 uL PKH工作液 至步骤1的溶液中,并用涡旋混合器充分混合
3. 在 37℃ 下培养 30 min。
4. 将全部溶液转移至离心过滤管中。
5. 在室温下以 3,000 x g 离心 5 min。
6. 向过滤管中加入 100 uL PBS。
7. 在室温下 3,000 x g 离心 5 min。
8. 再次重复步骤 7 和 8。
9. 在室温下以 3,000 xg 再次离心 5 min,以使剩余溶液滤净。
10. 当离心速度>3,000 x g 时,外泌体也会通过滤膜,导致回收量降低。如果溶液仍然存在,请重复离心直至所有溶液滤净。
11. 吸取 50 uL PBS 至过滤管中,注意枪头不要碰触到未反应的染料,轻轻吹打,并将收集的染色后外泌体转移到新微型管中。
*由于未反应的染料也保留在滤膜上,枪头如果直接接残留的染料可能会造成污染。
向细胞中添加外泌体
1. 去除培养基,并用 PBS 洗涤1次。
2. 去除 PBS,然后加入新鲜的含血清培养基。
3. 吸取 1-50 uL染色的外泌体至细胞中,并在 37℃ 5% CO2 培养箱中培养 1-24 h。
4. 去除上清液,用 PBS 洗涤 2 次。
5. 去除 PBS,加入新鲜的含血清培养基,用荧光显微镜观察。
用 HeLa 细胞观察荧光强度随外泌体添加量和培养时间的变化
1. 将HeLa 细胞(1.25x104个细胞/孔)接种在 μ-Slide 8 Well Plate上,并在 37℃5% CO2培养箱中过夜培养。
2. 去除培养基,用 PBS 洗涤1次,并加入 200 uL新鲜的含 10% FBS 的 DMEM 培养基。
3. 将已用 ExoSparkler 外泌体膜染色试剂盒染色并纯化过的外泌体(5 /10 μg 蛋白,粒子数为50/100x108个),加入到含有 Hela 细胞的孔中。
4. 在 37℃ 5% COd培养箱中培养 2 或 4 h。
5. 去除培养基,并用 PBS 洗涤 2 次。
6. 去除 PBS,加入 200 uL新鲜的含 10% FBS 的 DMEM 培养基,用荧光显微镜观察
*用超速离心从悬浮细胞 HEK293 的上清液中纯化外泌体并使用。
*用 BCA 法测量蛋白质的量,并且通过 Nanoparticles Tracking Analysis (NTA)测量粒子数。
注意事项:
1. 染料的⼯作液随⽤随配,不要将配好的染料贮存,影响染色效果。
2. PKH26 染色过程中,不能存在叠氮化物或代谢毒性物。
3. 虽然贴壁细胞也可以染⾊,但为获得均匀染⾊,单细胞悬液最佳。因此用蛋白酶(trypsin/EDTA)将贴壁细胞消化成单个悬浮细胞后再染色效果更佳。
4. 染色前去除血清和脂质以提高染色效果。
5. 盐的存在会导致染料形成颗粒,干扰染色反应。因此,加染料前细胞重新悬置很重要。染料 应直接加到细胞悬液中,而不是加到细胞团上。
6. 过度的细胞标记将导致膜完整性丧失、细胞数量下降。本样品细胞和染料浓度是参照浓度适合大部分细胞,但最佳染料/细胞由使用者根据细胞类型和实验目的决定,另外使用者还要评估细胞的生存力(排碘),荧光强度,荧光峰值的变异系数,染色的均匀性。
7. 染色浓度根据细胞种类的不同和每孔内细胞数量的多少而异。不同的细胞种类标记后可以示踪的代次或时间差异较⼤,请根据实际情况或参考文献进行检测。





